
- 1
- 2
医疗器械MDR新法规有何变化/MDR法规适用范围是什么?
发布时间:2019-11-13
近日公告机构BSI率先获得了欧盟新法规MDR(EU2017/745)的资格授权,也意味着近期BSI、TUV等公告机构陆续可以开始受理MDR的申请。
2017年2月医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)最终提案发布,2017年3月7日欧盟成员国一致投票表决同意欧盟采用新版的医疗器械法规(MDR)和体外诊断器械法规(IVDR)。2017年5月5日,欧盟正式发布了OfficialJournal其正式对外宣布了新版MDR(REGULATIONEU2017/745)法规和新的IVDR(REGULATIONEU2017/746)法规。新法规将取代现行的三个医疗器械指令:分别是医疗器械指令93/42/EEC,有源医疗器械指令90/385/EEC及体外诊断医疗器械指令98/79/EEC。
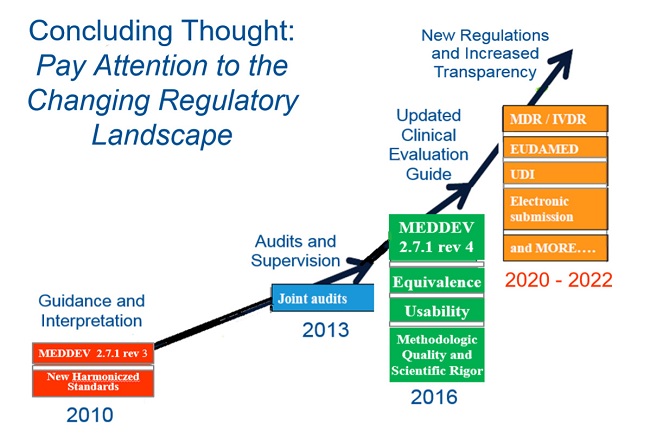
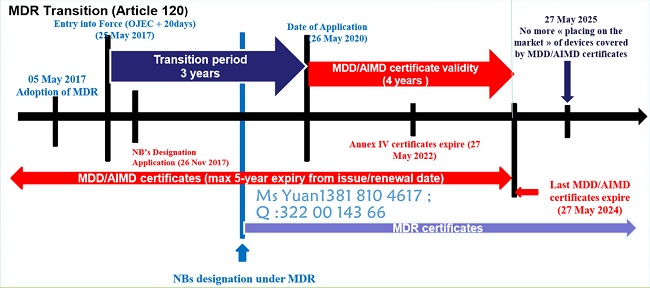
MDR转换期
欧盟委员会规定了MDR的转换期的要求,具体请见下图。目前已经有部分NB获得了MDR的资格可以开始受理MDR的认证申请。
MDR法规变化
1.1指令(Direve)升级为法规(Regulation)
指令(Direve):需在转换期之后转变为国家法律,对于实施指令的具体方式和方法,各成员国可以各不相同
法规(Regulation):是一种具有普遍适用性和总约束力的法令,法规一经生效,各成员国都必须执行,没有必要再制定相应的本国法规
1.2强化制造商的责任:指定合规负责人,制造商必须拥有至少一名具有医疗器械领域专知识的合规负责人;持续更新技术文件,制造商应建立并持续更新技术文件,植入物:不少于15年,其他产品不少于10年,当国家主管部门要求时,应提供技术文件,注册地址不在欧盟境内的制造商,应确保欧盟代表备有相关的文档,供政府主管部门检查;财务保障,制造商应以与风险等级,产品类型和企业规模相称的方式,采取措施,就85/374/EEC指令下的潜在责任提供足够的财务保障,但不影响国家法律规定的更多保护措施;相关方的监督,政府主管部门进行市场监督、产品和技术文件抽查,公告机构进行合格评定和飞行检查,欧盟授权代表验证制造商已经建立了EU符合性声明以及技术文件、验证制造商已经实施了适当的合格评定程序、验证制造商已经进行了注册(包括UDI)
1.3更严格的上市前评审,部分产品的分类等级变高,加强对临床证据的要求,对特定高风险器械将采用上市前审查机制,由欧盟级别的专家组参与,进行更严格的事先评估。
1.4使用范围扩大,非医疗用途,但其功能和风险特征与医疗器械相似的器械将同样纳入MDR的管理范围
1.5提高透明度和可追溯性,使用唯一器械标识(UDI)系统识别和追踪器械,患者将收到具有所有基本信息的植入卡,将建立包含器械认证的信息和临床研究、警戒和上市后监测信息的修订后的可公开访问的EUDAMED数据库
1.6加强警戒和市场监管,一旦器械可以在市场上使用,制造商将必须收集有关其性能的数据,欧盟国家将在市场监管领域进行更密切的协调。
根据多年的法规实践,建议将技术文件分为两部分:
A部分(概要)
制造商信息:名称、地址、生产场地
产品名称、分类
公告机构的信息以及合格评估路径
符合性声明
产品基本介绍:预期用途、规格型号、附件等
标签、使用说明书及语言的要求
基本要求检查表
风险分析和控制的概述
产品符合的法规和标准
产品验证和确认的概述
B部分其余技术相关内容,如:
产品详细信息
基本要求的支持性证据
测试报告
临床数据
风险管理文档
过程确认
制造、检验的文件
应用的标准
亿博检测高级销售顾问certified engineer

周倩联系方式:13543272815 座机:027-87609413
传真:027-88180138
邮箱:zhouqian@ebotek.cn
地址:深圳市宝安区西乡街道银田工业区侨鸿盛文化创意园A栋219-220
下一篇:医疗器械CE认证指令介绍






